
成人呼吸窘迫综合征,以下简称ARDS,是急性呼吸衰竭的一种,由于它的发病率较高且病死率一直高达50%左右而受到人们的重视。从1967年美Ashbaugh等首次提出此名称,20年来围绕此病征开展了大量的临床和实验室研究,至今仍未能阐清它的发病机制,在急诊医学中亦占有重要位置。
一、简史
早在40年代就有关于“创伤后湿肺”的报道,描述在严重创伤后发生的急性呼吸衰竭;1950年又有作者以“充血性肺不张”的名称诊断类似病征;60年代以来,由于创伤和失血性休克等治疗条件的改善,急性呼吸衰竭的重要性渐又突出,“休克肺”的诊治问题再次被重视。至1967年美Ashbaugh等人首次报道平民创伤后的急性呼吸衰竭,提出临床表现与新生儿呼吸窘迫综合征颇多相似之处,当时认为表现活性物质代谢和功能失常是病征的主要病因,提出了成人呼吸窘迫综合征(ARDS)这一名称。经历了20年发病机制方面的研究,虽然已知表面活性物质的失常在此病征中的作用与新生儿呼吸窘迫综合征中并不相同,但ARDS这一病名已为较多学者所接受,取代了众多各种类似的名称。
ARDS指的是一组严重的临床综合征,其特征是进行性加重的呼吸困难,一般常用的给氧方法难以纠正的低氧血症,X线胸片示双肺弥漫性浸润阴影。可引起本病征的病因很多,患病率较高,1976年美国约有150000名患者,1982年美费城某医学中心本病占该院危重住院患者的5%,在美克拉雷多州三个医院的本病征高危因素患者(指休克、败血症、外伤等)993人中发现ARDS 88例。国内虽无准确发病率的调查报告,但有关本病征较大数目的病例报道日多。而病死率虽经20年的努力仍高达50%左右,故一般均认为它是重危患者致命的重要病因。
二、ARDS的病因
多种致病因子或直接作用于肺,或作用于远离肺的组织,造成肺组织的急性损伤引起相同的临床征候。
(一)直接作用于肺的致病原因 如创伤、误吸、毒物吸入、各种病原体引起的严重肺部感染和放射性损伤等。
(二)间接原因 如败血症、休克、肺外创伤、药物中毒、输血、坏死性胰腺炎、体外循环等。
三、ARDS的病理形态学和病理生理学改变
ARDS的组织形态学改变可分为三期。渗出期(于发病后24~96h)特点是间质和肺泡内水肿、毛细血管充血,间质内红、白细胞浸润。Ⅰ型肺泡上皮细胞呈不同程度退行性变,甚至坏死脱落,裸露出基底膜。于严重上皮细胞损伤处,特别在呼吸性细支气管和肺泡管处可见到透明膜形成。血管内皮细胞变化相对较轻。微血管中常见到由白细胞、血小板、纤维蛋白形成的微血栓。病变严重处呈现出血坏死区。增生期(发病第3~10天)Ⅱ型肺泡上皮细胞增生,覆盖肺泡表面,间质因白细胞、成纤维细胞浸润和纤维组织增生而变厚,毛细血管减少,肺泡塌陷。纤维化期(自发病第7~10天开始)特点为肺泡间隔和透明膜处纤维组织沉积和纤维化,并渐发展至全肺。
急性期肺组织外观充血、水肿、出血、实变。因此,病理形态学的表现并无特异性,实际上反映了严重广泛的肺组织损伤的共同性变化。
由于本病征最关键性的变化是肺泡上皮和血管内皮细胞受损,使肺泡毛细血管膜通透性增加,蛋白含量高的水肿液渗漏入肺泡间隔和肺泡腔内。于是肺的顺应性下降,肺变硬。同时Ⅱ型肺泡上皮细胞损伤,肺泡表面活性物质生成障碍,使肺泡表面张力降低,肺泡变得不稳定,容易塌陷,产生微小肺不张,肺顺应性进一步下降,以致功能残气量下降,肺弹性回力增加,肺组织更易萎陷。此时,存在大面积的低 /
/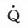 区,肺内分流量显著增加,出现严重的低氧血症。如前所述,此种呼吸衰竭用提高吸入气氧浓度的措施不能纠正,严重时,传统的间歇正压通气方式(CMV)也不能改善。
区,肺内分流量显著增加,出现严重的低氧血症。如前所述,此种呼吸衰竭用提高吸入气氧浓度的措施不能纠正,严重时,传统的间歇正压通气方式(CMV)也不能改善。
四、ARDS的临床表现
(一)起病 一般多在原发致病因子(如休克、创伤等)发生后,经过一短暂的相对稳定期(也被称为潜伏期,约24~48h)出现下述呼吸困难等症状,但也有时起病急骤、迅即出现严重呼吸衰竭者(即暴发型),也有时起病较缓渐者。潜伏期发生的原因可能与表面活性物质的代谢或与白细胞的动员有关。
(二)临床特征 患者表现严重的呼吸困难,呼吸频率增速可达30~50次/min。鼻翼煽动,辅助呼吸肌运动增强。口唇、甲床明显紫绀。肺部体征常不如症状明显,呼吸音增强,有时可闻及哮鸣音或少量湿性啰音。胸部X线早期只表现纹理增深,常迅速出现以侧弥漫性浸润性阴影。
呼吸功能检查可发现每分钟通气量明显增加,可超过20L/min。肺静态总顺应性可降至153~408ml/kPa(15~40ml/cmH2O)。功能残气量显著下降。
动脉血氧分压降低,吸入气氧浓度大于50%(FiO2>0.5)时,PaO2仍低于8.0kPa(60mmHg),PaCO2可正常或降低,至疾病晚期方增高。PA-aO2显著增加,当FiO2=1.0时,PaO2低于46.7kPa(350mmHg)。计算QS/QT常超过30%,或PaO2/PAO2≤0.2。
以漂浮导管进行血流动力学监测时,肺毛细血管楔压(PCWP)≤2.13kPa(160mmHg)是一项重要诊断指标,但当合并左心功能不全或应用呼气末正压通气(PEEP)治疗时,应当注意它们对PCWP测量结果的影响。
五、诊断
目前各临床单位对ARDS的诊断标准虽不尽相同,一般不外从以下诸方面考虑:即严重的低氧血症需依赖机械通气的支持,胸片示双肺弥漫性浸润性阴影,静态肺顺应性≤510kPa(50ml/cmH2O),PaO2/PAO2≤0.2和PCWP≤2.13kPa(16mmHg)。当患者能够满足以上指标时虽能得到较肯定的诊断,但病情均已发展到重笃阶段,病死率甚高。即使近十几年来随着机械通气方式的改进,ARDS患者藉机械通气的帮助,虽有时能使PaO2保持在6.67kPa(50mmHg)以上,可保证必要的氧合功能,但仍常因心血管、肾、脑或肝等脏器同时或相继出现功能衰竭而最终归于不治。加以最近有些学者提出多系统器官衰竭(MSOF或MOF)的概念,认为MSOF与ARDS具有共同的病理生理学变化,肺常是第一个出现衰竭的器官。因此对临床工作者提出早期诊断的要求,以便及时诊治,提高ARDS或MSCF的存活率。事实上,已有学者对存在发生ARDS高危因素的患者如重症肺炎、感染中毒性休克病人中进行前瞻性监测,及时检出ARDS患者,以期改善本病征的预后。但仍然需要寻找—可靠、为临床实用的早期诊断指标,这一要求的实现有赖于对ARDS发病机制的继续深入研究,一旦了解肺泡毛细血管膜通透性改变的机制,有可能寻求到早期诊断的指标,同时也就有可能有针对性地提高治疗效果。
目前,对肺灌洗液的临床测定,某些物质如血管紧张素转换酶,纤维连接蛋白,人白细胞弹性蛋白酶,纤维蛋白降解产物碎片等测定的观察,均是在寻找能够作为早期诊断的标帜物,迄今尚未有理想的发现,仍是临床研究工作者继续努力的目标。