
一、强碱弱酸盐溶液的PH值
一元强碱弱酸盐溶液,例如 NaOAc 溶液中:
NaOAc→Na++OAc-
Na+不与水电离出的OH-结合,它与溶液的酸碱性无关。OAc-是HOAc的共轭碱,与水作用放出OH-使溶液显碱性。

上式的平衡常数,也就是弱碱的离解常数:

表3-5 一些一元弱碱的离解常数(18-25℃)
|
碱 |
分子式或离子 |
Kb |
PkB | |
|
碱的强度增 |
二甲胺 |
(CH3)2NH |
1.18×10-3 |
2.93 |
|
乙胺 |
C2H5NH2 |
4.7×10-4 |
3.33 | |
|
氨 |
NH3 |
1.76×10-5 |
4.75 | |
|
硼酸根离子 |
H2BO-3 |
1.37×10-5 |
4.86 | |
|
次氯酸根离子 |
CLO- |
3.38×10-7 |
6.47 | |
|
吡啶 |
C5H5N |
1.61×10-9 |
8.79 | |
|
醋酸根离子 |
OAc- |
5.68×10-10 |
9.25 | |
|
苯胺 |
C6H5NH2 |
4.0×10-10 |
9.40 | |
|
氟离子 |
F- |
2.83×10-11 |
10.55 | |
表3-5 列出了一些一元弱碱的离解常数。通过Kb和碱的浓度c(OAc-的浓度近似地等于盐NaOAc的浓度),即可根据(式2-4)计算溶液中[OH-]及PH值,而不必像经典理论那样通过盐的水解来解释和计算。

使用这个公式的条件是c/Kb≥500。
例3计算0.100mol.L-1naOAc溶液的 pH值。

pOH=-lg[OH-]=-lg7.54*10-6=5.12
pH=14-pOH=14-5.12=8.88
多元弱酸的强碱盐溶液PH值的计算,与一元强碱弱酸盐相类似。因 Kb1》Kb2 ,溶液中[OH-]主要由第一级碱式离解所产生,而第二级碱式离解产生的OH-及弱酸很少,可以忽略。计算时以Kb1代入式(2-4)中之Kb,即可算出[OH-]。例如Na2CO3溶液中

设Na2CO3的浓度为0.100mol·L-,c/Kb1=0.100/1.78×10-4>500,用式(2-4)计算
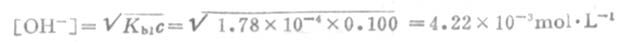
pOH=2.37
pH=14-2.37=11.63