
一、EDTA配合沆定的基本原理
(一)EDTA配合滴定的基本原理
EDTA(用H4Y表示)是一个多元酸,在溶液中以H4Y,H3Y-,HY3-,Y4-等形式存在。其中Y4-能与多种金属离子直接配合生成稳定的配合物,配合比为1:1。
金属离子与EDTA形成的配合物的稳定性常用稳定常数的对数表示。EDTA与金属离子形成配合物的反应如下(为简单起见略去电荷):

 (7-6)
(7-6)
 (7-7)
(7-7)
Ks或lgKs越大,配合物越稳定。表7-2列举了一些常见金属离子与EDTA形成配合物的lgKs值,
表7-2 EDTA金属离子配合离子lgKs值
|
金属离子 |
配合离子 |
lgKs |
金属离子 |
配合离子 |
lgKs |
金属离子 |
配合离子 |
lgKs |
|
Na+ |
NaY3- |
1.66 |
Fe2+ |
FeY2- |
14.33 |
Cu2+ |
CuY2- |
18.7 |
|
Li+ |
LiY3- |
2.79 |
Al3+ |
AlY- |
16.11 |
Hg2+ |
HgY2- |
21.8 |
|
Ag+ |
AgY3- |
7.32 |
Co2+ |
CoY2- |
16.31 |
Sn2+ |
SnY2- |
22.1 |
|
Ba2+ |
BaY2- |
7.78 |
Cd2+ |
CdY2- |
16.40 |
Bi3+ |
BiY- |
22.8 |
|
Mg2+ |
MgY2- |
8.64 |
Zn2+ |
ZnY2- |
16.40 |
Cr3+ |
CrY- |
23.0 |
|
Ca2+ |
CaY2- |
11.0 |
Pb2+ |
PbY2- |
18.30 |
Fe3+ |
FeY- |
24.23 |
|
Mn2+ |
MnY2- |
13.8 |
Ni2+ |
NiY2- |
18.56 |
Co3+ |
CoY- |
36.0 |
式(7-6)中的[Y]是指平衡时的[Y4-],不包括EDTA其他存在形式,故称Ks为配合物的绝对常数,它与溶液的酸度无关。表7-2中所列数据均为绝对稳定常数。由于EDTA是弱酸性的配合剂,因此溶液的酸度对EDTA配合物的稳定性有很大的影响。
1.酸度的影响
酸度的影响可用下式表示:

可见溶液的酸度越高,[Y4-]越低,越不利于配合滴定的进行;溶液的酸度越低[Y4-]越高,配合滴定进行得越完全。EDTA溶液中除了Y4-外,还存在其他形式。设EDTA总浓度为[Y]总,则
[Y]总=[H4Y]+[HY-]+[HY2-]+[HY3-]+[Y4-](7-8)
[Y]总与[Y4-]之间存在着一定的比例关系。
[Y]总=αH·[Y-4]
αH=[Y]总/[Y4-]
比例系数aH叫做酸效应系数,它是随酸度的增大而增大,aH可以从EDTA的各级电离常数和溶液中[H+]计算出来。
将式(7-9)代入式(7-6)可得
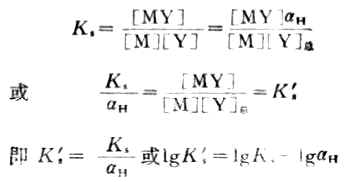 (7-10)
(7-10)
式中Ks' 是考虑了酸效应的稳定常数,叫做条件稳定常数或表观稳定常数,在不同酸度下,KS是不变的,但由于aH随酸度增大而增大,故Ks'则随酸度的增大而减小。在配合滴定中,要求反应量的完成,Ks'越大,反应进行得越完全。
如被测金属离子的初始浓度为0.02mol·L-1,当反应完全时,金属离子基本都配合成MY,即得[MY]=1.0×10-2mol·L-1,设测定的允许误差为0.1%,则滴定达到平衡时,
[M=[Y]≤1.0*10-2*0.1%=1.0*10-5(mol·L-1)
将这一关系代入式(7-10)则得

或lgKs'≥8 (7-11)
可见MY配合物的 Ks'必须等于或大于1.0×108,才能满足滴定误差小于0.1%的要求
由式(7-10)可得
lgαH≤lgKs-8 (7-12)
利用上式,再根据7-3可以求得滴定各种多金属离子所允许的最低PH值。
7-3 不同PH时EDTA的lgaH
| pH | lgaH | pH | lgaH | pH | lgaH |
| 0 | 21.18 | 4 | 8.44 | 8 | 2.26 |
| 1 | 17.20 | 5 | 6.45 | 9 | 1.28 |
| 2 | 13.52 | 6 | 4.65 | 10 | 0.45 |
| 3 | 10.60 | 7 | 3.32 | 11 | 0.07 |
在滴定过程中也应控制一定的酸度,因为EDTA在滴定中不断有H+释放出来,使溶液的PH值降低。例如用EDTA二钠溶液滴定Ca2+时,其反应式如下:

因此配合滴定常需用缓冲控制酸度。
2.其他配合剂的影响
溶液中存在其他配合剂时的影响用下式表示:
 Z代表其他配合剂,n为Z的系数。由于其他配合剂的存在,降低了金属离子的浓度,使平衡向左移动。配合滴定中常常利用这个原理消除干扰离子。例如,用EDTA滴定Mg2+和Cd2+、Zn2+混合液中的Mg2+时,可在滴定前向混合液中加入KCN,使Cd2+和Zn2+与CN-形成稳定的[Zn(CN)4]2-和[Cd(CN)4]2-(Mg2+不与CN-配合),从而消除了Cd2+和Zn2+对滴定的干扰。这种消除干扰的作用叫掩蔽作用,起掩蔽作用的配合剂叫掩蔽剂。
Z代表其他配合剂,n为Z的系数。由于其他配合剂的存在,降低了金属离子的浓度,使平衡向左移动。配合滴定中常常利用这个原理消除干扰离子。例如,用EDTA滴定Mg2+和Cd2+、Zn2+混合液中的Mg2+时,可在滴定前向混合液中加入KCN,使Cd2+和Zn2+与CN-形成稳定的[Zn(CN)4]2-和[Cd(CN)4]2-(Mg2+不与CN-配合),从而消除了Cd2+和Zn2+对滴定的干扰。这种消除干扰的作用叫掩蔽作用,起掩蔽作用的配合剂叫掩蔽剂。